В 1911 году Э. Резерфорд на основе проделанных им экспериментов обосновал наличие в атоме положительно заряженного ядра. Схему опыта Резерфорда вы видите на рисунке. В цилиндре 1 находилось радиоактивное вещество, испускавшее поток α-частиц 2. Они попадали на тонкую золотую фольгу 3 и, взаимодействуя с ней, ударялись об экран 4. В местах ударов частиц на экране возникали вспышки света 5.
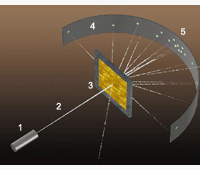
То, что некоторые α-частицы значительно меняли направление полёта, противоречило «рыхлой» модели атома Томсона (см. § 15-б). Резерфорд рассуждал так. Если некоторые α-частицы отлетают назад, значит, сильный положительный заряд есть и в атомах фольги. Но поскольку большая часть α-частиц пролетает сквозь фольгу, почти не отклоняясь, этот положительный заряд занимает малую часть атома. Её назвали ядром атома.
Подсчитывая α-частицы, отклоняющиеся на разные углы, определили размеры ядра атома: около 10-14 м. Это приблизительно в 10 000 раз меньше самого атома. Поэтому Резерфорду пришлось в своей ядерной модели атома всё незанятое ядром пространство в атоме «заполнить» электронами. Он писал так: «Атом состоит из центрального электрического заряда, сосредоточенного в точке и окружённого однородным сферическим распределением противоположного электричества равной величины».
Резерфорд не указывал, как именно в атоме расположены электроны и движутся ли они. Его эксперимент и не мог дать ответ на этот вопрос, но родилось предположение, что электроны движутся вокруг ядра подобно планетам вокруг Солнца. Однако тогда электроны имели бы центростремительное ускорение (см. § 12-л). И, как и любые движущиеся с ускорением заряды, они излучали бы электромагнитные волны (см. § 11-з). С течением времени, теряя энергию, все электроны неизбежно «упали» бы на ядро. Но размеры никаких атомов не уменьшаются. Значит, гипотеза о движении электронов неверна?
Первый шаг на пути снятия противоречия между планетарной моделью атома и его долговечностью был сделан в 1913 году датчанином Н. Бором. Он развил идеи Планка о квантовании энергии (см. § 15-а) и предположил, что кванты испускаются атомами, а не электронами. Согласно Бору, атомная система (ядро и электроны) может находиться в энергетически устойчивых состояниях, при переходах между которыми испускаются или поглощаются кванты излучения, переносящие энергию.
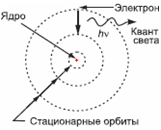
Бору удалось вывести формулу, описывающую положения линий в спектрах водорода и других одновалентных атомов (см. § 14-й). Сделанные расчёты положений спектральных линий совпадали с наблюдаемыми спектрами. Их происхождение теория Бора легко объясняла прерывистым характером допустимых значений энергии атома.
Следующие шаги для понимания причин устойчивости атомов привели к отказу от понятия орбиты электрона в пользу понятий электронных уровней и подуровней. Поэтому с середины XX века планетарная модель в физике не используется. Несмотря на это, квантование энергии атомной системы является одним из главных принципов физики по сей день.
Перейдём к рассмотрению строения ядра атома. В 1919 году Э. Резерфорд, бомбардируя атомы азота ядрами атомов гелия, обнаружил появление ядер атомов водорода. Аналогичная бомбардировка натрия, алюминия, неона и других элементов тоже порождала ядра атомов водорода. Их назвали протонами и сделали вывод, что они входят в состав ядер всех атомов. В 1932 году английский физик Д. Чедвик открыл нейтрон – частицу ядра с массой, равной массе протона, и без электрического заряда.
В настоящее время считается, что атомное ядро состоит из протонов и нейтронов, вместе именуемых нуклонами (лат. «нуклеус» – ядро). Ядра прочны благодаря наличию особых ядерных сил, действующих между всеми нуклонами. Эти силы примерно в 100 раз интенсивнее электрических, но действуют только на расстояниях до 10-15 м, то есть в пределах ядра.