В начале ХХ века моделью ядра атома служил шарик диаметром около 10-14 м, имеющий положительный заряд. Но раз есть заряд, то должен существовать и его носитель — некая частица. И вскоре она была обнаружена.
Взгляните еще раз на рисунок треков частиц в камере Вильсона. Большинство из них принадлежат a-частицам. Один из треков представляет собой «вилку». Это говорит о том, что вместо одной заряженной частицы в камере образовались две другие. Оказалось, что разветвление трека – результат столкновения a-частицы с атомом азота. Сложными опытами было выяснено, что одна из образовавшихся частиц обладает почти такой же массой, как и атом водорода и зарядом, равным заряду электрона, но со знаком «+». Частица получила название «протон».
Два десятилетия спустя, в 1932 г английский физик Д.Чедвик открывает частицу, масса которой приблизительно равна массе протона, но без электрического заряда. Эту частицу назвали «нейтрон».
В середине 1930-х независимо друг от друга советский физик Д.Д. Иваненко и немецкий физик В. Гейзенберг выдвинули гипотезу, что атомное ядро состоит из протонов и нейтронов, получивших общее название «нуклоны» (лат. «нуклеус» – ядро).
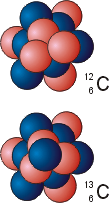
В пользу этой гипотезы говорило существование изотопов – элементов, имеющих различную атомную массу, но одинаковые химические свойства. Поскольку эти свойства зависят только от строения электронных оболочек элемента, значит все изотопы имеют одинаковое количество электронов, а, следовательно, и протонов в ядре. Тогда различие атомных масс изотопов легко объясняется различным количеством нейтронов в их ядрах. Так, например, все изотопы углерода имеют по 6 протонов в ядре, но атомные массы стабильных изотопов могут быть равными 12 или 13 а.е.м.
Ядро атома каждого химического элемента имеет следующее обозначение: ? . Здесь Х – символ элемента, Z и А – зарядовое и массовое числа ядра элемента. Зарядовое число принято измерять количеством входящих в него протонов; оно равно порядковому номеру данного элемента в таблице Менделеева. Массовое число ядра равно количеству входящих в него нуклонов: A=Z+N, где N – количество нейтронов. Например, обозначение относится к верхнему рисунку и означает, что ядро этого атома углерода имеет зарядовое число 6 и массовое число 12. В природе существует и другой изотоп углерода ? (нижний рисунок).
В ядерной физике так же, как и в химии, за единицу массы принимается 1 атомная единица массы (1а.е.м.), равная 1/12 массы ядра изотопа углерода ? . Поскольку оно состоит из 12 нуклонов, значит, на 1 нуклон этого ядра приходится точно 1 а.е.м. Но в таблице Менделеева атомные массы элементов (в том числе и углерода) являются дробными числами. Почему?
Это объясняется главным образом тем, что химические элементы состоят из смеси изотопов с различными атомными массами. Например, в природе изотоп углерода встречается гораздо реже, чем изотоп ? . Именно поэтому в таблице Менделеева относительная атомная масса углерода имеет дробное значение: 12,0011 а.е.м. Оно получилось в результате усреднения атомных масс изотопов с учетом их процентного содержания в природе.
Итак, для определения массовых чисел ядер можно воспользоваться следующим правилом: массовое число ядра, как правило, совпадает с округленным значением атомной массы элемента, приведенной в таблице Менделеева.
Вещества, в состав молекул которых входят разные изотопы одного и того же элемента, обладают различными физическими свойствами. Например, вода, образованная изотопом водорода ? , имеет плотность 1100 кг/м3 и поэтому называется тяжелой водой. Другие ее физические свойства также отличаются от обычной воды.