Мы завершили изучение строения и основных свойств твёрдых, жидких и газообразных тел с точки зрения МКТ. Переходим теперь к рассмотрению «механизмов» агрегатных превращений. Вспомним их названия, известные нам из 7 класса (см. схему).
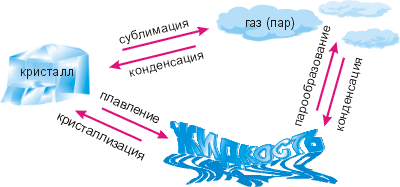 |
По сравнению с 7 классом на схеме есть изменения. Во-первых, термин «твёрдое тело» мы заменили на более точный «кристалл» и, соответственно, термин «отвердевание» на термин «кристаллизация». Именно к этому явлению относится формула Q=λm. Если из отвердевающей жидкости получается аморфное твёрдое тело, эта формула неприменима (так как меняется температура), поэтому нужно применять формулу Q=cmΔt°.
В дополнение к сказанному назовём типично кристаллические и типично аморфные тела. Существование в виде кристаллов свойственно для льда, хрусталя, алмаза, парафина, стеарина, минеральных солей и всех металлов и их сплавов. Существование в аморфном виде свойственно стеклу, всем смолам и пластмассам (поэтому они так и называются: «пластические массы»).
Во-вторых, на схеме противоположно стрелке «сублимация» появилась стрелка «конденсация». Дело в том, что твёрдое и жидкое состояния вещества по причине их высокой плотности объединяют термином конденсированные среды (от лат. «конденсаре» – уплотняю, сгущаю). Как видно из таблицы плотностей, которую мы рассмотрели в § 2-г, плотности жидких и твёрдых тел обычно в 100–1000 раз больше плотности газов.
Важно! Какое бы изменение состояния вещества ни происходило – сублимация или конденсация, плавление или кристаллизация, парообразование или конденсация – при этом обязательно меняются энергии частиц: кинетическая и потенциальная. Поясним это.
При повышении температуры ускоряется движение частиц вещества. Поскольку их масса не меняется, увеличение скорости движения частиц означает увеличение их кинетической энергии. Частицы энергичнее «расталкивают» друг друга, в результате чего увеличиваются расстояния между ними, ослабевают силы притяжения, уменьшается (по модулю) потенциальная энергия взаимодействия частиц друг с другом.
Поэтому, для каждого кристаллического тела существует определённая температура (её называют температурой плавления), при которой кинетическая энергия многих частиц тела начинает превосходить их потенциальную энергию (по модулю). Эти наиболее «энергичные» частицы, совершая всё большие колебания, нарушают порядок в расположении частиц, образовывая жидкость (см. рисунок).
 |
Аналогично, для каждого жидкого тела существует определённая температура (её называют температурой кипения), при которой кинетическая энергия многих частиц оказывается достаточной, чтобы эти наиболее «энергичные» частицы растолкали своих соседок по жидкости и образовали газообразное вещество (пузырёк пара внутри жидкости).
А для обратного превращения газ (пар) → жидкость → кристалл частицы вещества должны отдать часть своей кинетической энергии, чтобы она не превосходила (по модулю) потенциальную энергию притяжения к другим частицам. Тогда их силы притяжения смогут удерживать бывшие «энергичные» частицы рядом с собой и появятся капельки жидкости или твёрдые кристаллики.