Проведём эксперимент по графическому исследованию конденсации. Легко сжижающийся газ, например аммиак, поместим в цилиндр с прозрачными стенками и будем сдавливать поршнем (см. нижнюю часть рисунка). Изменение объёма газа будем отслеживать по меткам на цилиндре, а изменение давления – по манометру. По этим данным построим график (см. верхнюю часть рисунка).
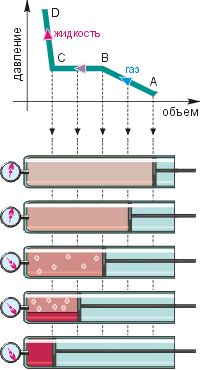 |
На этапе AB объём уменьшался, а давление увеличивалось. Однако при этом аммиак оставался газом. На этапе BC объём продолжал уменьшаться, однако давление оставалось постоянным. При этом на стенках конденсировались капельки сжиженного газа, стекавшие вниз.
Некоторые газы принято называть парами: водяной пар, пары бензина, ртути, и т.п. Так говорят про те вещества, которые при обычных условиях (это комнатная температура и атмосферное давление) более устойчивы в жидком состоянии, чем в газообразном. Сжижение таких газов (паров) можно вызвать не только сжатием, но и просто охлаждением. Для сжижения же «настоящих газов» их необходимо сжимать и охлаждать одновременно.
При определённом соотношении температуры и давления конденсация газов может происходить сразу до твёрдого состояния, минуя жидкое. Так происходит, например, при конденсации углекислого газа (см. § 2-г, таблица внизу) – он превращается сразу в «сухой лёд», используемый для хранения мороженого.
Конденсацию газов МКТ объясняет так: при сближении частиц газа между ними возникают силы притяжения, и частицы «слипаются», образуя (в зависимости от температуры и давления) капельки жидкости или твёрдые кристаллики. Поэтому твёрдое и жидкое состояния вместе называют конденсированными средами.
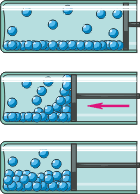 |
Взгляните ещё раз на график: на участке BC в цилиндре одновременно сосуществуют газ и жидкость, их температуры равны, а давление газа не зависит от объёма. Как это может быть? Вдвигая поршень, мы на мгновение увеличиваем давление газа около поршня, и это способствует переходу части молекул газа в жидкость. В итоге давление газа вновь становится прежним (см. рисунок). Говорят, что внутри цилиндра наблюдается термодинамическое равновесие (см. § 6-б).
Газ (пар), находящийся в термодинамическом равновесии со своей жидкостью, называется насыщенным паром. Прилагательное «насыщенный» подчёркивает, что при данных температуре и давлении пар не может содержать большее число частиц в единице объёма (то есть иметь большую плотность).
Давление насыщенного пара – это характеристика вещества, по которой можно распознать неизвестный газ. У различных веществ давление их насыщенных паров различно (см. таблицу). Вещества с малым значением при обычных условиях являются твёрдыми или жидкими (ртуть, вода при 0°С, спирт); с большим значением – газообразными (вода при 100°С, аммиак); при средних значениях – вещество либо легко испаряющаяся жидкость, либо легко сжижающийся газ (эфир).
| Давление насыщенного пара, кПа (при 20 °С) | ||||
| Ртуть | 0,0002 | Эфир | 60 | |
| Вода (при 0°С) | 2,3 | Вода (при 100°С) | 101 | |
| Спирт | 5,9 | Аммиак | 857 | |
При повышении температуры давление насыщенных паров повышается, как и давление любого другого газа (см. § 5-г). Это показано также и в строке таблицы «Вода». При 0°С давление паров воды мало, поэтому при этой температуре вода будет существовать преимущественно в жидком состоянии. Однако при температуре 100°С давление насыщенных паров воды равно 101 кПа, то есть равно атмосферному давлению. Выше этой температуры (при давлениях не больше атмосферного) вода будет существовать в газообразном состоянии – в виде водяного пара.